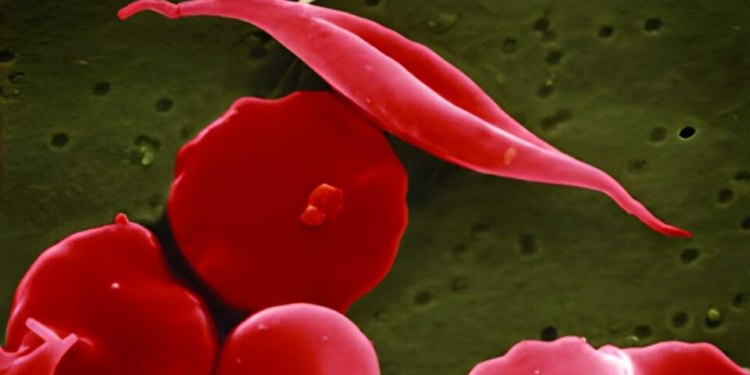
A anemia falciforme, uma doença genética associada à herança africana, é um dos problemas hereditários mais bem compreendidos pela ciência. Os cientistas sabem qual é a alteração exata no DNA que muda a hemoglobina nos portadores, sabem que a forma de foice das células vermelhas do sangue que dá nome à doença (“falciforme” significa “em forma de foice”) vem dos filamentos de hemoglobina que empurram as extremidades das células. Sabem até mesmo o provável motivo de sua disseminação apesar dos problemas que causa: a mutação também dá uma vantagem contra a malária.
Os geneticistas só não sabiam como curá-la, e os médicos só tratavam os sintomas. Isso, com o primeiro paciente a ter o DNA alterado por novas técnicas descobertas nos últimos dez anos, acaba de mudar. Um jovem de 20 anos, paciente do médico e pesquisador Matthew Heeney, do Hospital Pediátrico de Boston (EUA), ganhou um tratamento experimental em que seu gene da hemoglobina foi restaurado para a condição mais comum na população, sem a mutação da anemia falciforme.
Foi a primeira pessoa no mundo a ter a mutação “corrigida” por novas técnicas moleculares de terapia gênica.
O primeiro paciente a ter a doença genética curada
O americano Branden Baptiste sentiu as dores de sua alteração genética já aos dois anos de idade. Seus pais o levavam ao hospital com frequência: o menino sentia dor e não sabiam por quê. “A partir dos 12 anos, as coisas pioraram muito”, disse o jovem, hoje com 20 anos de idade. “Eu ia para o hospital mês sim, mês não, em crise”. Todo ano ele precisava faltar dois meses de aula ao todo. O diagnóstico correto de anemia falciforme demorou, mas veio com os anos.
As hemácias (células vermelhas) só são afetadas pela hemoglobina mutada em condições de baixo oxigênio no sangue. As pequenas “foices” são formadas, por isso, em extremidades do corpo e juntas, e tornam as coisas piores, pois são pouco eficientes em transportar o oxigênio comparadas às células normais.
Baptiste teve que fazer cirurgia quando estava no sexto ano do ensino fundamental para substituir o lado esquerdo do quadril, danificado pela falta de oxigênio. Pouco tempo depois, precisou fazer o mesmo com o lado direito. Aos 17 anos, quase morreu de síndrome torácica aguda — é uma complicação grave, comum em pessoas com anemia falciforme, caracterizada por dor no peito, febre e dificuldade para respirar, causada por bloqueio dos vasos sanguíneos pulmonares pelas células alteradas.
“Pensei que era o fim. Não conseguia respirar. Se eu inalasse um pouco, sentia como se alguém estivesse esfaqueando meu pulmão”, contou Baptiste. Foi apenas o primeiro de cinco episódios da síndrome torácica naquele mesmo ano. Ele perdeu um ano inteiro do Ensino Médio e foi parar na Unidade de Tratamento Intensivo.
Como funciona a nova técnica de terapia genética
Foi neste estado que Baptiste conheceu Heeney e foi incluído no estudo clínico “BEACON” (“farol” em inglês), sediado no hospital de Boston. O nome completo da pesquisa é “BEACON: estudo para avaliar a segurança e a eficácia do BEAM-101 em pacientes com doença falciforme grave”.
BEAM-101 é uma técnica baseada na tecnologia CRISPR, que consiste na utilização de enzimas encontradas em bactérias que são capazes de modificar o DNA de formas previsíveis. Essas bactérias usam essas moléculas como uma forma de sistema imunológico, para combater vírus que as parasitam
O DNA, a molécula que é nosso material genético, é uma longa fita em dupla hélice formada por quatro blocos fundamentais representados pelas letras A, T, C e G. O BEAM-101 é um refinamento do CRISPR que permite alterar letras individuais sem riscos de cortar o DNA — e uma mudança de letra, a troca de um A por um T, é exatamente o que causa a anemia falciforme.
Quando Branden Baptiste aceitou fazer parte do experimento, seus sintomas já estavam insuportáveis. “Eu pensava ‘por que ainda estou na escola? Com esta idade eu já deveria estar na universidade”, disse o jovem.
O experimento começou em 2023. Uma série de testes foram feitos para assegurar que Baptiste tinha saúde para suportar a terapia gênica. Em outubro, já estava preparado. Células-tronco que são responsáveis por produzir as hemácias foram coletadas de seu organismo, o que exigiu duas internações por vários dias.
Depois, ele foi submetido à quimioterapia, a mesma aplicada em pacientes com câncer, para matar as células-tronco portadoras da mutação que restaram em sua medula óssea.
As células coletadas foram tratadas com o BEAM-101 para corrigir a mutação falciforme, e finalmente reintroduzidas no organismo de Baptiste em 5 de dezembro de 2023.
Agora era torcer para que as células retornassem sem problemas à medula óssea e começassem a produzir as células sanguíneas livres da mutação. Baptiste permaneceu sob observação no hospital por semanas. Ele passou o tempo assistindo a série Suits na Netflix e jogando PlayStation.
Na véspera de Natal, Baptiste voltou para casa, para alegria de sua família. Foi antes da data esperada para a alta no hospital. “Disseram que eu ficaria no hospital por dois meses, mas eu saí em 20 dias”, conta ele. “Todos ficaram chocados, inclusive os médicos”.
Um ano depois, Baptiste se sente livre dos sintomas da anemia falciforme e parou de tomar os remédios que precisava antes. “Na minha opinião, estou perfeito. Nunca me senti bem antes — antes, ‘bem’ significava dor moderada que eu pudesse aguentar respirando fundo. Agora, estou mais que bem.” Ele planeja começar logo seu curso universitário de engenharia civil. Também descobriu a atividade física, antes impossível. “Estou malhando todo dia”, disse.
“O tratamento transformou Branden”, disse Heeney. “Não só a contagem de células do sangue e os marcadores de doenças estão normais, como agora ele faz tarefas diárias que a maioria das pessoas considera banais, mas antes estavam fora de seu alcance. É uma alegria vê-lo fazendo planos que pareciam impossíveis apenas um ou dois anos atrás”.
A etapa de quimioterapia necessária demonstra que o tratamento ainda não é para todos os portadores, pois alguns podem ser intolerantes aos medicamentos. Existem outros tratamentos em teste, como um tratamento que faz o organismo adulto voltar a produzir a forma fetal da hemoglobina, que não causa as células falciformes — era a segunda opção de Baptiste.
O potencial da técnica é enorme. O banco de doenças genéticas OMIM (sigla em inglês para “Herança Mendeliana no Homem Online”), mantido pela Universidade Johns Hopkins, cataloga milhares de doenças causadas por alteração em uma única letra do DNA. Entre elas estão fibrose cística, fenilcetonúria, distrofia muscular de Duchenne e a cruel doença de Tay-Sachs, que é neurodegenerativa e mata crianças.
noticia por : Gazeta do Povo